„Sistemele CRISPR-Cas” în bacterii și viruși identifică și distrug secvențele virale invadatoare. Este un sistem imunitar bacterian și arheal pentru protecție împotriva infecțiilor virale. În 2012, sistemul CRISPR-Cas a fost recunoscut drept a genomului instrument de editare. De atunci, s-a dezvoltat o gamă largă de sisteme CRISPR-Cas și au găsit aplicații în domenii precum terapia genică, diagnosticare, cercetare și îmbunătățirea culturilor. Cu toate acestea, sistemele CRISPR-Cas disponibile în prezent au o utilizare clinică limitată din cauza apariției frecvente de editare în afara țintei, a mutațiilor ADN neașteptate și a problemelor moștenite. Cercetătorii au raportat recent un nou sistem CRISPR-Cas care poate viza și distruge ARNm și proteine asociate cu diferite boli genetice mai precis, fără impact nețintă și probleme moștenite. Denumit Craspase, este primul sistem CRISPR-Cas care apare proteină functie de editare. Este, de asemenea, primul sistem care poate edita atât ARN, cât și proteină. Deoarece Craspase depășește multe limitări ale sistemelor CRISPR-Cas existente, are potențialul de a revoluționa terapia genică, diagnosticarea și monitorizarea, cercetarea biomedicală și îmbunătățirea culturilor.
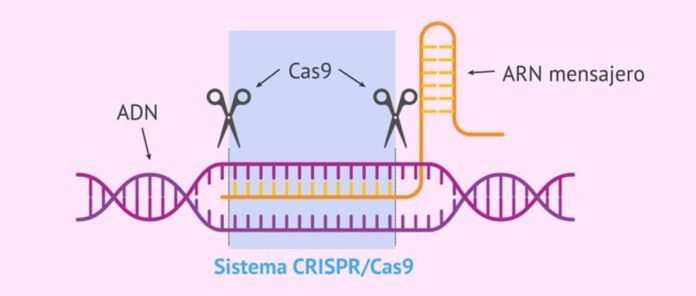
„Sistemul CRISPR-Cas” este un sistem imunitar natural al bacteriilor și arheilor împotriva infecțiilor virale care identifică, leagă și degradează secvențele din gena virală pentru a le proteja. Este format din două părți – ARN bacterian transcris din gena virală încorporată în genomul bacterian după prima infecție (numită CRISPR, aceasta identifică secvențele țintă ale genelor virale invadatoare) și un distrugător asociat. proteină numită „CRISPR asociat proteină (Cas)” care leagă și degradează secvențele identificate în gena virală pentru a proteja bacteriile împotriva virușilor.
CRISPER înseamnă „repetări palindromice scurte, interspațiate în mod regulat, grupate”. Este transcris ARN bacterian caracterizat prin repetări palindromice.
Repetările palindromice (CRISPR) au fost descoperite pentru prima dată în secvențele de E. coli în 1987. În 1995, Francisco Mojica a observat structuri similare în arhee și el a fost primul care a considerat acestea ca făcând parte din sistemul imunitar al bacteriilor și arheilor. În 2008, s-a demonstrat experimental pentru prima dată că ținta sistemului imunitar al bacteriilor și arheilor era ADN-ul străin și nu ARNm. Mecanismul de identificare și degradare a secvențelor virale a sugerat că astfel de sisteme ar putea fi utilizate ca instrument pentru editarea genomului. De la recunoașterea sa ca instrument de editare a genomului în 2012, sistemul CRISPR-Cas a parcurs un drum foarte lung ca standard stabilit ferm. editarea genelor sistem și a găsit o gamă largă de aplicații în biomedicină, agricultură, industriile farmaceutice, inclusiv în terapia genetică clinică1,2.
O gamă largă de CRISPR-Sistemele CAS sunt deja identificate și disponibile în prezent pentru monitorizarea și editarea secvențelor ADN/ARN pentru cercetare, screening de medicamente, diagnosticare și tratamente. Sistemele actuale CRISPR/Cas sunt împărțite în 2 clase (Clasa 1 și 2) și șase tipuri (Tipul I până la XI). Sistemele de clasa 1 au mai multe Cas proteine care trebuie să formeze un complex funcțional pentru a se lega și a acționa asupra țintelor lor. Pe de altă parte, sistemele din clasa 2 au un singur Cas mare proteină pentru legarea și degradarea secvențelor țintă, ceea ce face sistemele de clasa 2 mai ușor de utilizat. Sistemele de Clasa 2 utilizate în mod obișnuit sunt Cas 9 Tip II, Cas13 Tip VI și Cas12 Tip V. Aceste sisteme pot avea efecte colaterale nedorite și anume, impact în afara țintei și citotoxicitate3,5.
Terapii genetice bazate pe sistemele actuale CRISPR-Cas au o utilizare clinică limitată din cauza apariției frecvente de editare în afara țintă, mutații neașteptate ale ADN-ului, inclusiv ștergeri mari de fragmente de ADN și variante mari structurale ADN atât la locurile țintă, cât și în afara țintă, ceea ce duce la moartea celulelor. și alte probleme moștenite.
Craspase (sau caspază ghidată de CRISPR)
Cercetătorii au raportat recent un nou sistem CRISPER-Cas, care este un sistem Cas2-7 de Clasa 11 Tip III-E asociat cu o caspază asemănătoare proteină deci numit Craspase sau caspază ghidată de CRISPR 5 (Caspazele sunt cistein-proteaze care joacă un rol cheie în apoptoză în descompunerea structurilor celulare). Are aplicații potențiale în domenii precum terapia genică și diagnosticarea. Craspaza este ghidată de ARN și țintită de ARN și nu se implică în secvențele ADN. Poate viza și distruge ARNm și proteine asociate cu diferite boli genetice cu mai multă acuratețe, fără impact în afara țintei. Astfel, eliminarea genelor asociate cu boli este posibilă prin clivaj la nivel de ARNm sau proteine. De asemenea, atunci când este legată de o enzimă specifică, Craspaza poate fi folosită și pentru a modifica funcțiile proteinelor. Când funcțiile sale de RNază și protează sunt îndepărtate, Craspase devine dezactivată (dCraspase). Nu are funcție de tăiere, dar se leagă cu secvențele de ARN și proteine. Prin urmare, dCraspase poate fi utilizat în diagnosticare și imagistică pentru a monitoriza și diagnostica boli sau viruși.
Craspase este primul sistem CRISPR-Cas care prezintă funcția de editare a proteinelor. Este, de asemenea, primul sistem care poate edita atât ARN, cât și proteine. Este editarea genelor funcția are efecte minime în afara țintei și fără probleme moștenite. Prin urmare, este posibil ca Craspase să fie mai sigur în utilizare clinică și terapeutică decât alte sisteme CRISPR-Ca disponibile în prezent. 4,5.
Deoarece Craspase depășește multe limitări ale sistemelor CRISPR-Cas existente, are potențialul de a revoluționa terapia genică, diagnosticarea și monitorizarea, cercetarea biomedicală și îmbunătățirea culturilor. Este nevoie de mai multe cercetări pentru a dezvolta un sistem de livrare fiabil pentru a viza cu exactitate genele cauzatoare de boli din celule înainte de a dovedi siguranța și eficacitatea în studiile clinice.
***
Referinte:
- Gostimskaya, I. CRISPR–Cas9: O istorie a descoperirii sale și considerații etice ale utilizării sale în editarea genomului. Biochimie Moscova 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- Chao Li et al 2022. Instrumente și resurse de calcul pentru editarea genomului CRISPR/Cas. Genomica, Proteomica si Bioinformatica. Disponibil online pe 24 martie 2022. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. et al. Sisteme CRISPR–Cas care vizează ARN. Nat Rev Microbiol 21, 21–34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Chunyi Hu et al 2022. Craspasa este o protează CRISPR ghidată de ARN, activată de ARN. Ştiinţă. 25 Aug 2022. Vol 377, Issue 6612. pp. 1278-1285. DOI: https://doi.org/10.1126/science.add5064
- Huo, G., Shepherd, J. & Pan, X. Craspase: A roman CRISPR/Cas dual gene editor. Functional & Integrative Genomics 23, 98 (2023). Publicat: 23 martie 2023. DOI: https://doi.org/10.1007/s10142-023-01024-0
***